On sait depuis longtemps que toutes les molécules possèdent deux charges égales et opposées qui sont séparées par une certaine distance. Dans le cas de telles molécules polaires, le centre de charge négative ne coïncide pas avec le centre de charge positive. L'étendue de la polarité dans de telles molécules covalentes peut être décrite par le terme moment dipolaire, qui est essentiellement la mesure de la polarité dans une liaison covalente polaire.
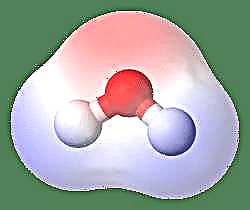
L'exemple le plus simple d'un dipôle est une molécule d'eau. Une molécule d'eau est polaire en raison du partage inégal de ses électrons dans une structure «courbée». La molécule d'eau forme un angle, avec des atomes d'hydrogène aux extrémités et de l'oxygène au sommet. Puisque l'oxygène a une électronégativité plus élevée que l'hydrogène, le côté de la molécule avec l'atome d'oxygène a une charge négative partielle tandis que l'hydrogène, au centre, a une charge positive partielle. Pour cette raison, la direction du moment dipolaire pointe vers l'oxygène.
Dans le langage de la physique, le moment dipolaire électrique est une mesure de la séparation des charges électriques positives et négatives dans un système de charges, c'est-à-dire une mesure de la polarité globale du système de charges - c'est-à-dire la séparation des molécules de charge électrique, qui conduit à un dipôle. Mathématiquement, et dans le cas simple de deux charges ponctuelles, une avec charge + q et une avec charge? Q, le moment dipolaire électrique p peut être exprimé comme: p = qd, où d est le vecteur de déplacement pointant de la charge négative vers la charge positive. Ainsi, le vecteur de moment dipolaire électrique p pointe de la charge négative à la charge positive.
Une autre façon de voir les choses est de représenter le moment dipolaire par la lettre grecque m, m = ed, où e est la charge électrique et d est la distance de séparation. Il est exprimé en unités de Debye et écrit comme D (où 1 Debye = 1 x 10-18e.s.u cm). Un moment dipolaire est une quantité vectorielle et est donc représenté par une petite flèche avec une queue au centre positif et la tête pointant vers un centre négatif. Dans le cas d'une molécule d'eau, le moment dipolaire est de 1,85 D, alors qu'une molécule d'acide chlorhydrique est de 1,03 D et peut être représentée comme:
Nous avons écrit de nombreux articles sur le moment dipolaire pour Space Magazine. Voici un article sur la composition de l'eau et voici un article sur les molécules.
Si vous souhaitez plus d'informations sur le moment dipolaire, consultez ces articles de Hyperphysics et Science Daily.
Nous avons également enregistré un épisode complet d'Astronomy Cast consacré aux molécules dans l'espace. Écoutez ici, épisode 116: Molécules dans l'espace.
Sources:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule